胃癌是全球第五大常见恶性肿瘤,也是癌症相关死亡的第三大原因,每年夺走全球近80万人的生命,更是中国乃至东亚地区的“癌症头号杀手”之一。此外,早期胃癌患者的5年生存率超过80%,可一旦进展到晚期,这一数字便骤降至20%以下。巨大的生存率反差,凸显出胃癌早诊早治的紧迫性。
目前临床上约80%的胃癌属于肠型。尽管医学界对其发展的病理机制已有一定认知,但仍缺乏能在癌前阶段进行有效干预、逆转病变的临床策略。
据悉,本次研究区别于以往依赖不同患者、不同阶段组织“拼凑”癌变过程的传统研究模式,创新性地利用内镜黏膜下剥离术(ESD)获取的连续病变组织样本,结合AI赋能的单细胞转录组(scRNA-seq)与空间转录组(ST)技术,在同一患者体内完整描绘了从正常胃黏膜、经肠上皮化生,直至早期胃癌形成的连续演变过程。
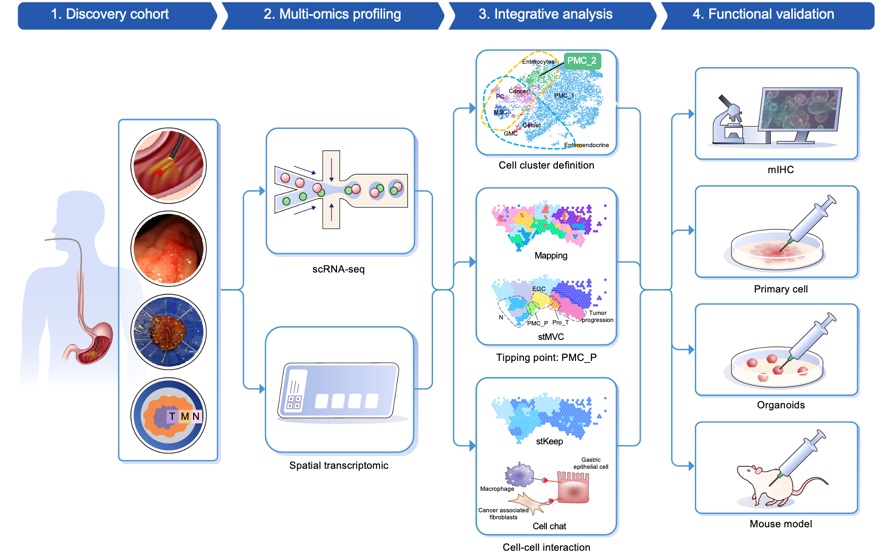
研究团队成功鉴定出一个位于肿瘤前缘的关键临界区域——PMC_P,该区域富含一类具有干性和炎症特征的胃小凹黏液细胞(PMC_2)。这些细胞通过NAMPT–ITGA5/ITGB1轴与成纤维细胞互作,并通过AREG–EGFR/ERBB2轴与巨噬细胞通信,共同激活JAK-STAT、MAPK和NF-κB等致癌通路,促进免疫抑制微环境形成(如PD-L1上调),从而驱动EGC的起始。
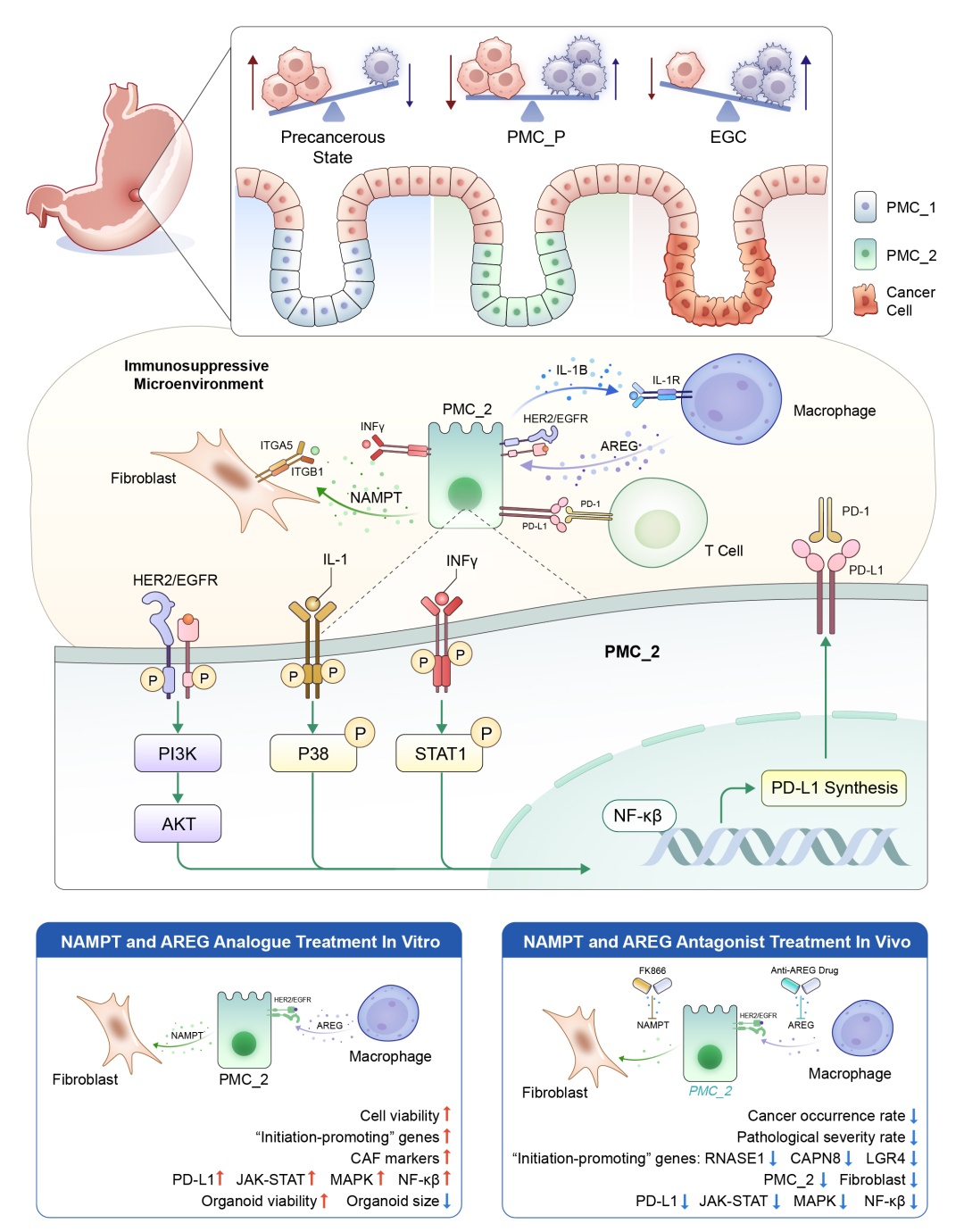
研究进一步通过原代癌前细胞系、类器官模型及CEA-SV40转基因小鼠模型验证了上述机制。结果显示,靶向抑制NAMPT或AREG可显著延缓疾病进展并阻止恶性转化。临床样本分析也证实了NAMPT与AREG在癌前区域的高表达与其促癌功能一致。
该研究紧扣领域内关于胃早癌起源机制的关键知识空白,提供了从正常、癌前病变向早期癌转变的连续、动态、空间定位的分子细胞图谱。其有望显著提升胃癌的早期诊断率和治疗效果,推动胃癌防治策略从“晚期治疗”向“早期干预”的根本性转变,具有重要的临床转化前景。
复旦大学附属中山医院内镜中心周平红教授、李全林教授与中山大学左春满教授为共同通讯作者。复旦大学附属中山医院郜娉婷副研究员为本文第一作者。该研究获得了上海市东方英才计划青年项目(QNKJ2024006)、国家自然科学基金(82170555、32300523、32570769、62132015)、上海市学术/技术带头人计划(22XD1422400)、上海市教育发展基金会和上海市教育委员会“曙光计划”(22SG06)支持。
点击“阅读原文” 肠道息肉就是“癌前病变”?中山医院内镜AI实现“全自动标注”