
限制性饮食联合抑制剂治疗,能显著提升肿瘤疗效。北京时间今天(11月21日)零点,同济大学医学院、同济大学附属第十人民医院王平教授团队在国际顶级学术期刊《自然》(Nature)上发表题为“Human HDAC6 senses valine abundancy to regulate DNA damage”(人类HDAC6 通过感知缬氨酸丰度调控DNA损伤)的论文,提出缬氨酸限制性饮食联合DNA修复酶抑制剂治疗肿瘤的新策略。这也是团队研究成果时隔9个月后再登《自然》。
缬氨酸,作为一种必需的支链氨基酸,在蛋白质合成、神经行为、白血病进展中发挥着重要的作用。然而,细胞感应缬氨酸的机制与功能尚不清楚。为系统性鉴定缬氨酸的结合蛋白,研究团队通过质谱技术,筛选得到缬氨酸结合蛋白去乙酰化酶HDAC6,显示出与缬氨酸更强的结合能力。研究团队进一步发现,有别于灵长类(人和猴子)的HDAC6,鼠的HDAC6并不能与缬氨酸发生结合。这一发现揭示了不同物种在缬氨酸感应中的差异性,提示了物种进化在氨基酸感应中的重要作用。研究团队还通过诸多实验发现,细胞内缬氨酸匮乏能促进DNA损伤。由此,研究团队发现了全新的缬氨酸感应器,阐明了缬氨酸限制诱导DNA损伤的分子机制。
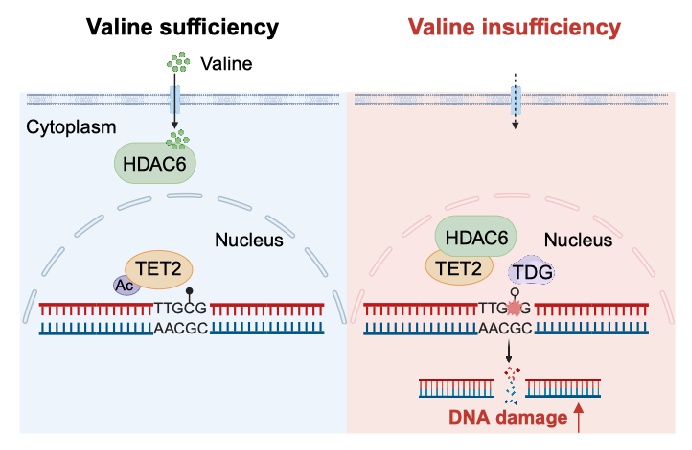
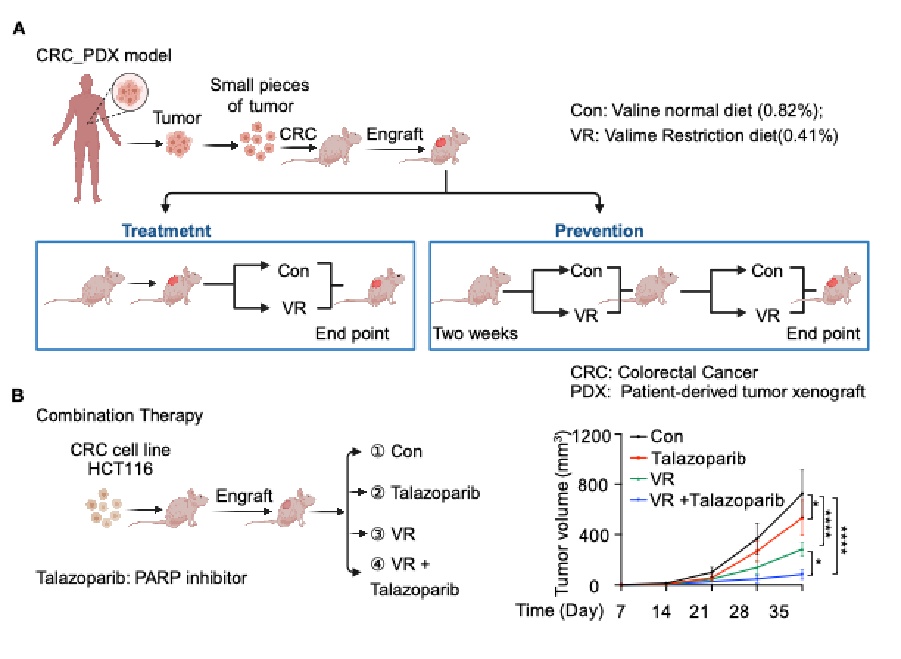
饮食限制或者靶向氨基酸代谢和感应,已成为延长寿命和癌症等多种疾病治疗的辅助策略。研究团队进而研究发现,在结直肠癌异种移植瘤和预防组、治疗组病人来源的异种移植肿瘤模型中,适宜的缬氨酸限制饮食(质量比为0.41%缬氨酸)可显著抑制肿瘤生长,同时产生的副作用较小。此外,缬氨酸限制性饮食和DNA修复酶抑制剂talazoparib(他拉唑帕利)联合治疗显著增强抗肿瘤效果,这为该疗法通过诱导DNA损伤治疗癌症提供了有力的证据。
同济大学为论文的第一完成单位,王平教授为论文的唯一通讯作者,同济大学医学院金佳丽、孟通、俞媛媛和中国科学院分子细胞科学卓越创新中心吴树恒为该论文共同第一作者。该研究得到了同济大学江赐忠教授、中国科学院分子细胞科学卓越创新中心吴薇研究员、耶鲁大学吴殿青教授、同济大学医学院袁健教授、同济大学薛剑煌教授/王子昕、华东师范大学陈益华教授和沈阳药科大学曹昊教授等团队的合作和支持。本项研究获得了国家自然科学基金委国际合作项目、重点项目以及科技部国家重点研发计划等项目的资助。
点击【阅读原文】查看论文详情
1月31日,王平教授团队(李亚旭、冉巧、段秋慧、金佳丽为共同第一作者)在 Nature 期刊发表了题为:7-Dehydrocholesterol dictates ferroptosis sensitivity 的研究论文。

该研究发现并揭示了远端胆固醇合成通路关键酶通过调控7-脱氢胆固醇(7-DHC)的水平来调控铁死亡敏感性的机制,表明了通过药物调控7-DHC水平,是一种有前途的治疗癌症和缺血再灌注损伤的新策略。
“今年见刊的这2项研究工作,都是经过了我们多年长时间的积累,可谓‘十年磨一剑’。”王平教授说,这些年来,团队围绕共同感兴趣的科学问题,潜心研究,执着探索,付出了极大的努力。团队长期深耕肿瘤微环境的基础研究和转化研究,致力于通过持续科研攻关找寻到攻击肿瘤细胞的分子机制,以期为肿瘤诊疗带来新思路和新策略。
“我们对一些根本性的科学问题很感兴趣,这往往需要敢于挑战传统学术观念,另辟蹊径。”他以这次发表的研究工作为例说,“我们想了解教科书中描述的经典氨基酸感应机制是否是唯一的感应途径,探索肿瘤细胞如何感应特定营养成分的变化,例如某种氨基酸水平的波动,以及靶向这种非经典的氨基酸感应机制是否能为肿瘤诊疗开辟新途径。”

来源:同济大学
编辑:拾
↓分享
↓点赞
↓在看